Qu'entend-on par GxP ?
Le domaine de connaissance GxP Basics répond aux questions sur la conformité GxP. Vous trouverez des informations sur les normes et les lignes directrices applicables et sur les exigences en matière de documentation conforme aux BPF.
Vous trouverez ici les réponses aux questions suivantes:
- Qu'entend-on par GxP?
- Quelles normes et directives jouent un rôle dans l'environnement BPF – GMP ?
- Quelles sont les industries qui opèrent dans un environnement réglementé par les BPF - GMP?
- Quelles sont les exigences auxquelles la documentation conforme aux BPF - GMP doit répondre ?
- Comment la gestion des risques est-elle définie dans la ligne directrice ICH Q9 ?
- Quels sont les principes de la gestion des risques dans les domaines réglementés par les BPF ?
- Quels sont les objectifs de la gestion des risques dans les domaines réglementés par les BPx ?
- Quelle méthode convient aux analyses de risques des entreprises ayant des exigences de conformité GxP ?
Qu'entend-on par "GxP" ?
GxP est le terme générique pour les sous-secteurs spécifiques réglementés par les BPF, tels que :
- BPF = Bonnes pratiques de fabrication
- GSP = Good Storage Practice (Bonnes pratiques de stockage)
- GDP = Goof Distribution Practice (Bonnes pratiques de distribution)
- GEP = Bonnes pratiques d'ingénierie
- GAMP = bonnes pratiques de fabrication automatisée
Quelles normes et directives jouent un rôle dans l'environnement BPF - GMP ?
Aperçu des réglementations les plus importantes dans l'environnement GMP :
- Réglementation nationale pour la France : directives sur la pharmacopée.
- Règlements de l'UE : Ligne directrice des BPF de l'UE, parties I à III, y compris les annexes
- U.S. Regs : Code des règlements fédéraux de la FDA (CFR)
- Règlements internationaux :
- Lignes directrices de l'ICH
- Guides PIC/S
- Guides ISPE
Quelles sont les industries qui opèrent dans un environnement réglementé par les BPF – GMP ?
Ces industries doivent se conformer aux directives et aux normes BPF :
Quelles sont les exigences auxquelles doit répondre la documentation conforme aux BPF – GMP ?
La documentation conforme aux BPF-GMP doit répondre à ces exigences :
- Elle doit se faire par écrit.
- Il doit être correct et complet.
- Elle doit être clairement formulée et toujours tenue à jour.
- Il doit toujours être disponible.
- La documentation doit être validée et signée par le représentant responsable de la qualité.
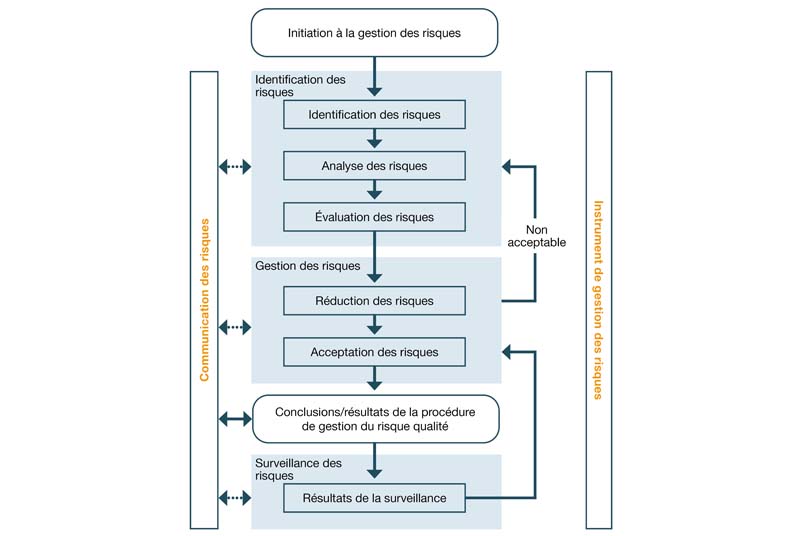
Comment la gestion des risques est-elle définie dans la ligne directrice ICH Q9 ?
Le processus de gestion des risques est décrit dans la directive ICH Q9, qui est fermement ancrée dans la partie III du guide des BPF de l'UE. Son objectif est d'établir un processus complet d'évaluation, de contrôle et de suivi des risques (voir la figure ci-dessous) tout au long du cycle de vie du produit, afin de maîtriser les erreurs et les risques potentiels pour la qualité du produit. Nombre de ces mesures sont identifiées au cours d'analyses de risques (par exemple, AMDE) et mises en œuvre au cours de la qualification et de la validation. On parle donc souvent de qualification fondée sur le risque et de validation fondée sur le risque dans l'environnement GxP.
Quels sont les principes de la gestion des risques dans les domaines réglementés par les BPF ?
Les principes suivants doivent être respectés :
- L'évaluation des risques liés à la qualité doit se fonder sur des preuves scientifiques et toujours être considérée dans le contexte de la protection des patients.
- Le niveau d'effort, les formalités et la documentation du processus de gestion du risque qualité doivent être adaptés au niveau de risque.
Quels sont les objectifs de la gestion des risques dans les domaines réglementés par les BPx ?
- Les faiblesses et les risques en matière de qualité des produits et de sécurité des patients doivent être mis en évidence.
- Les décisions doivent être prises de manière rationnelle et compréhensible.
- Les mesures de contrôle et de pilotage de la qualité doivent être définies sur la base des risques
- Promouvoir les échanges interdisciplinaires pour une meilleure identification des risques
- Les erreurs doivent être évitées ou contrôlées de manière proactive et préventive.
- Les processus décisionnels doivent être transparents pour toutes les parties concernées, par exemple également vis-à-vis des autorités.
Quelle méthode convient aux analyses de risques des entreprises ayant des exigences de conformité GxP ?
La méthode AMDE (AMDE = analyse des modes de défaillance et de leurs effets) est souvent utilisée pour les analyses de risques. L'avantage de cette méthode est qu'elle permet également de représenter des considérations très étendues de manière structurée. Cependant, il peut également être utile, surtout dans le cas de processus ou d'installations plus complexes, d'appliquer d'abord des méthodes de brainstorming telles que le diagramme d'Ishikawa ou le diagramme en arête de poisson.